反応機構の説明書 入門編 〜丸暗記からの卒業〜
- 有機化学初心者
- 反応機構を丸暗記しようとしている人
- 定期テスト対策に
有機化学って面白そうだなと感じた人に最初に降りかかる試練
それが「反応機構」ですよね。(僕はそうでした)
見たこともない記号から謎の矢印が出ていく様子を暗記しなくてはいけないなんて難しすぎる。これを覚えなきゃ単位が取れないのか…と絶望した人は今日から僕の同志です。
この記事では、「謎の図形」の丸暗記を卒業して「パズルゲーム」に変えるためのコツを伝授したいと思います。
このルールさえマスターできれば、単位をゲットするだけでなく、一人前の研究者にグッと近づけますよ。
今回は、入門編として反応機構パズルを攻略するための「ルール」と「攻略法」を考えていきましょう。
「反応機構」あんた一体何なのさ 何のために勉強するの?
ズバリ「反応機構」は、化学反応の説明書です。
ニトリやIKEAで家具を買ったとき、プラモデルやレゴを買ったとき、説明書を見ながら組み立てますよね。
説明書を見ないで作ることもできるかもしれませんが、気が遠くなるような時間がかかってしまいます。
化学反応の開発も同じです。
アテもなくひたすら試薬を混ぜていると、目的の反応条件を見つけるまでは何十、いや何百実験もかかってしまいます。
しかし、頭の中で反応機構が描ける条件で実験すれば大きく近道をすることができるのです。
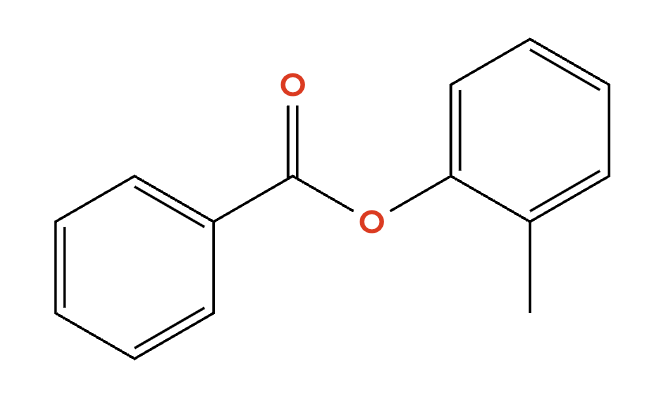
例えば、あなたが下の図にあるようなエステルを作りたいとしましょう。
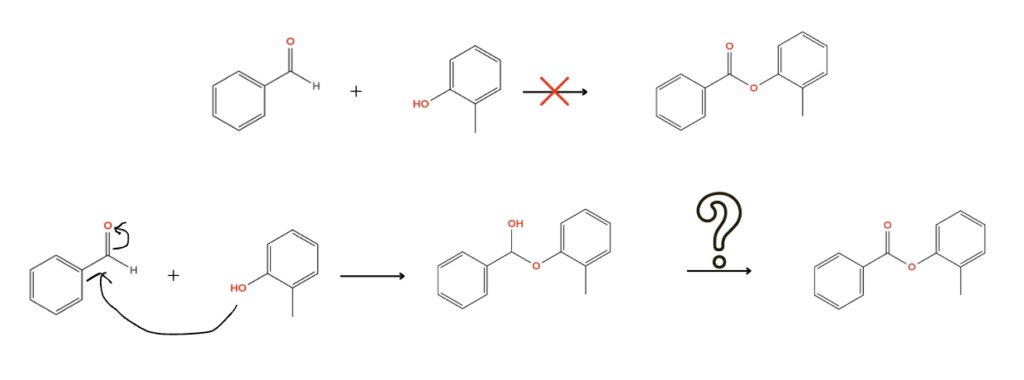
ここで、アルデヒドとアルコールから作ろうとした場合、普通の条件では反応機構が描けません。つまり、その反応は進行しないということです。
複数工程かければ合成できますが、二つを単純に混ぜるだけでは難しいです。逆に、ここから矢印をかけるような添加剤を考えられたら新反応として論文発表できるかも!
しかし、酸塩化物とアルコールから作ると?
簡単に反応機構が描けます。つまり、簡単に合成できるということです(ほんの少し条件検討は必要かもしれませんが、かなり短縮できます)。
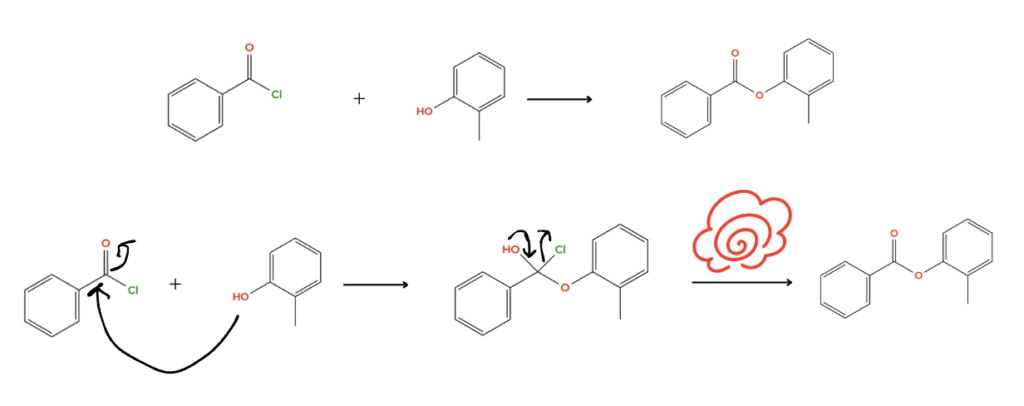
このように、「反応機構が描ける」ということは「正しい説明書である」ことの証明になるのです。
反応機構をマスターすれば、実際に実験する前にその反応がどの程度正しいのかを判断することができるようになります。
実際のラボの他に、頭の中にも自分専用のラボを持ててしまうんです!(かと言って実際に実験することは、やめないでくださいね。現実と頭の両方のラボをフル稼働させるのが偉大な研究者のステータスです。)
「反応機構」有用性が分かりましたか?
では、一緒に反応機構の攻略法をマスターしていきましょう。
反応機構パズルのルール 入門編
反応機構パズルのルールはたった1つ
それは「電子が多いところから電子が少ないところへ矢印を引く」これだけです。
電車に乗る時、混雑している車両と空いている車両があったら空いている方に乗りますよね。
人間も有機化合物も考えることは同じ。居心地が良い方へ良い方へと進んでいきたがるのです。
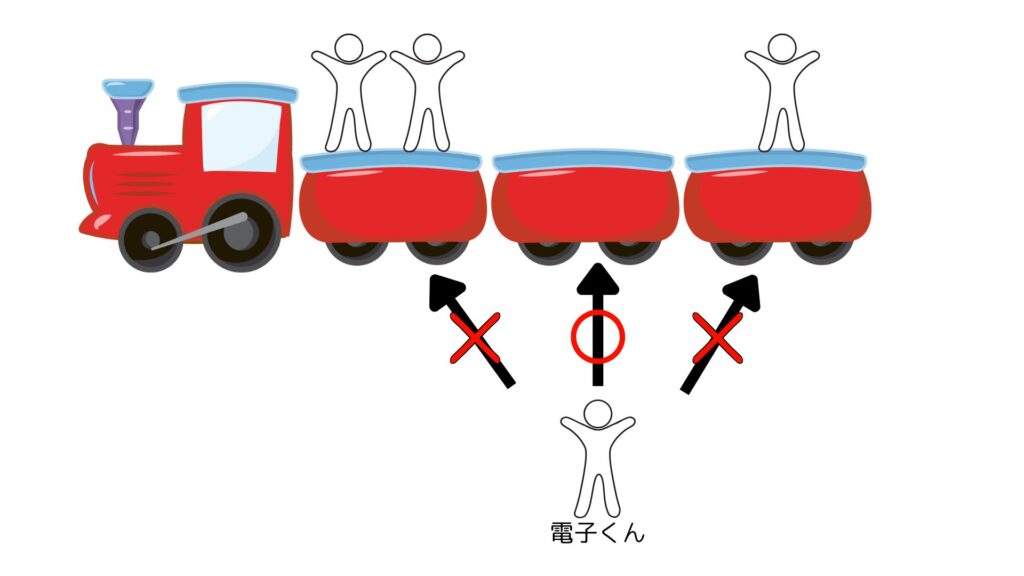
最終的に、全ての化合物が居心地の良い場所に移動(反応)を続けます。
みんなを落ち着いていられる状態にしてあげることが反応機構パズルの目的なのです。
電子の移動:反応機構における矢印、多いところから少ないところへ描く
化合物の居心地が良い:構造的、エネルギー的に安定な状態
反応機構パズルの攻略法 入門編 電子の量を見極めよう
まずは電子が多い奴らの見極め方から
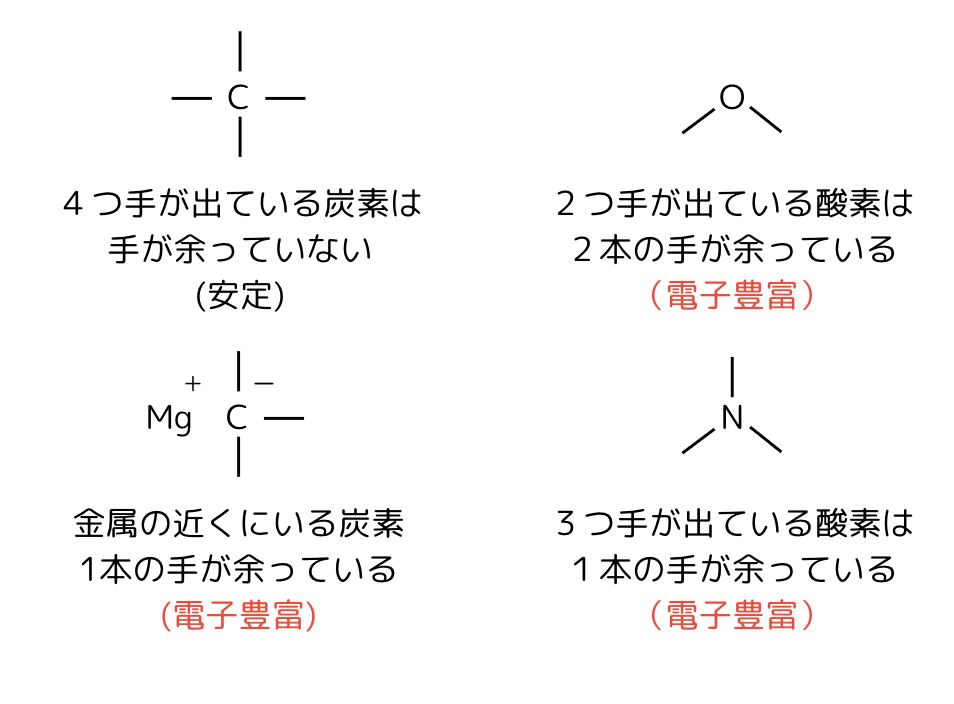
電子が多い箇所は、原子の手が余っているところです。
原子は水素(H)を除いて、基本的に4本の手を持っています。
しかし、結合に使える手の数は原子によって決まっています。
そこで、結合に使わない手(非共有電子対)を持っているものや、そもそも手が余っているもの(アニオン)は、「手が余っている」=「電子が余っている」と分かります。
例えば「酸素(O)」は結合に使える手が2本なので、基本的に2本の手を余らせています。
「窒素(N)」は結合に使える手が3本なので、1本の手を余らせています。
(詳しくはオクテット則で調べてみてください。)
また、金属(Na,Li,Mgなど)と炭素や酸素は手を繋ぐことができないので、金属にくっついている原子も手を余らせています。
(金属結合と共有結合の違い)
続いて電子が足りていない奴らの見極め方
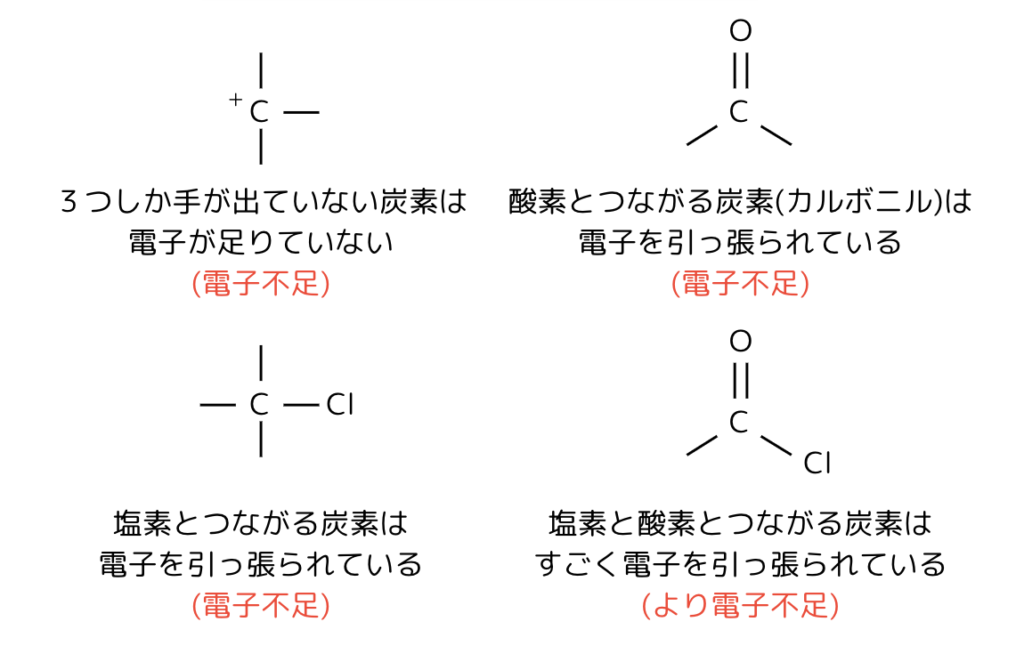
電子が少ないところは、電子を引っ張る奴らが近くにいるところです。
周期表の右上の方にいる原子は「欲張りさん」なので電子を欲しがる力(電気陰性度)が強いです。
つまり、「フッ素(F)」>「酸素(O)」>「塩素(Cl)」>「窒素(N)」,「臭素(Br)」>「炭素(C)」の順で電子を引っ張っています。
また、結合の手が足りていない原子も電子が不足しています。
カチオンは、「手が足りていない」=「電子が不足している」
すぐに覚えられたら苦労しないよ、と思っているあなたに攻略本を授けましょう
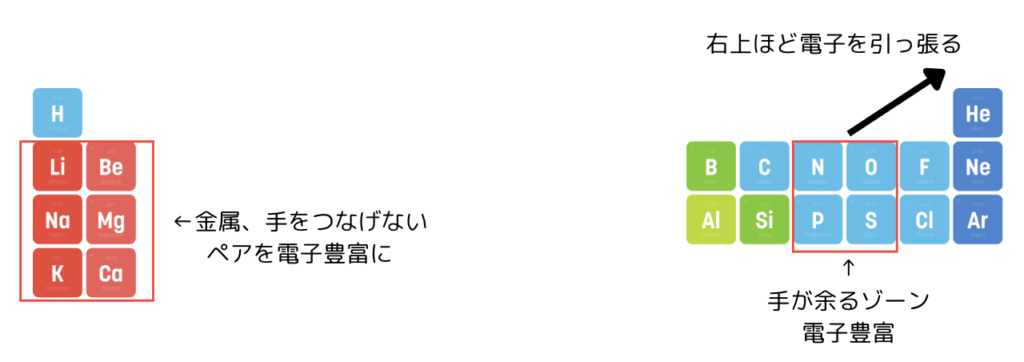
それは「周期表」です。
酸素の列は手が2本余っている、窒素の列は手が1本余っているので電子豊富です。
周期表の右上にある原子ほど電子を引っ張る力が強いです。
今回の振り返り
今回のルール「電子が多いところから少ないところへ」を考えながら下の図を見てみましょう

1.電子の多い酸素が攻撃を開始
2.攻撃されるのは酸素と塩素のつながっている電子不足な炭素
3.炭素の手は4本しかないので電子を引っ張っている酸素まで電子(矢印)が流れる
4.電子豊富な酸素が電子をあげたくなって、塩素が脱離する
5.エステルの完成
次回予告
反応機構の大原則、「電子は多いところから少ないところへ」が何となく分かってきましたか?
「何で最後に酸素(アルコール)じゃなくて塩素が抜けるの?」
「窒素と酸素がいたときはどっちから攻撃するの?」
「アルコールの酸素は攻撃できるのに、カルボニルの酸素は攻撃しないの?」
と思ったあなたは、勘が鋭い。その疑問を作る能力は研究者に向いています。
今回は入門編ということで説明は省略しましたが、次回以降の記事でフォローしていこうと思います。
分からないことがある場合は、お問い合わせフォームやXアカウントまで質問お待ちしています(平日の対応は遅くなるかもしれませんが、返信や新しい記事などで答えさせていただきます)。
Let’s Enjoy Organic Chemistry!



